研究内容research content
パーキンソン病における血液脳関門とペリサイトの病態生理
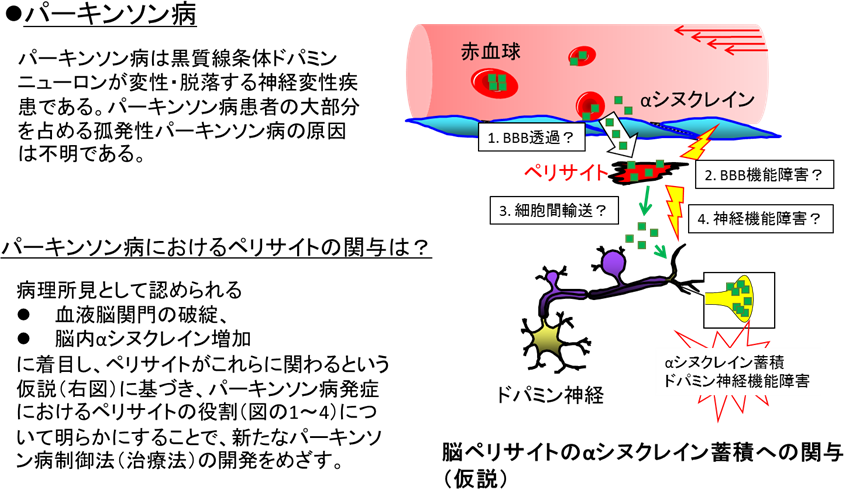
パーキンソン病は原因タンパク質であるαシヌクレインが脳内に蓄積し、発症します。本来脳内に存在するαシヌクレインは患者さんの血液中でも増加し、トランスポーターによって輸送され血液脳関門を透過して脳内へ入ってくることがわかりました。「血液中からのαシヌクレインの脳への移行を阻害すれば、病気の原因となるαシヌクレインの脳内での蓄積を防ぐことができる」と考え、αシヌクレインがどうやって血液脳関門を透過するのかを明らかにして、それを防ぐ方法を見つけ、パーキンソン病の予防・治療を目指します。
血液脳関門の構成細胞であるペリサイトは血液脳関門のバリア機能を強化するだけでなく、ドパミン神経細胞の機能を高めることがわかりました。このペリサイトがパーキンソン病の原因タンパク質であるαシヌクレインによって異常な状態(「活性化」)になり、血液脳関門を破綻させることがわかりました。パーキンソン病ではペリサイトがどのように異常になるのか原因を調べ、それを防ぐ方法を探しています。
また、ペリサイトがパーキンソン病の原因タンパク質であるαシヌクレインを分解して、脳内への蓄積を防ぐこともわかりました。現在のパーキンソン病治療薬は脳内で不足したドパミンを補充して症状を緩和するもの(レボドパなど)しかありませんが、シクロスポリンのような既存薬がペリサイトのαシヌクレイン分解作用を促進することがわかったので、パーキンソン病の原因(αシヌクレイン)を取り除くことができる新しい治療薬(根本的治療薬)になる可能性があります。しかし、シクロスポリンは血液脳関門を透過できず、副作用も多いため、他にもαシヌクレイン分解促進作用のある、安全で脳に入りやすい既存薬を探索して、新しい治療薬として医師へ提案したいと考えています。さらに、iPS細胞からペリサイトを作製することができたので、これを脳内へ移植することによってαシヌクレインを分解させる新しい治療法の開発を目指しています。
病態研究
思いもよらないことが原因で、パーキンソン病・てんかん・認知機能障害などの脳疾患の発症リスクが高まります。- 軽度な頭部外傷(たんこぶなど)→パーキンソン病・難治性てんかん・認知機能障害
- 炎症性腸疾患→パーキンソン病
- 加齢→高齢発症てんかん・パーキンソン病・認知機能障害
残念ながら、これら脳疾患の根本的治療は未だになく、画期的な治療法開発が熱望されています。
これら脳疾患に共通して認められるのが、血液脳関門(BBB)障害とBBB構成細胞であるペリサイトの病変化です。いちはやくペリサイトを治療し、その機能を正常化させることで、健やかな脳環境を整備し、病気に強い脳づくりを考えます。
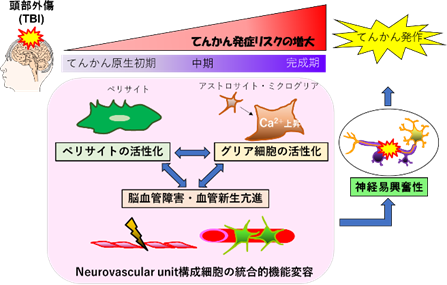
頭部外傷がパーキンソン病発症リスクを高めるメカニズムの解明
頭部外傷に伴い早期に活性化するペリサイトが、グリア細胞の活性化や神経機能異常を惹き起こすことを、これまで明らかにしてきました。パーキンソン病発症に、脳ペリサイトの活性化が関与するのか?この疑問を解決するために、頭部外傷モデルマウスや細胞を用いて、頭部外傷後の脳内のドパミン神経障害やαシヌクレイン蓄積のメカニズムを解明します。
頭部外傷後のけいれん閾値の低下に、脳ペリサイトの活性化が関与することが明らかになりました。「活性化ペリサイトはどのようなメカニズムで神経機能を過剰に興奮させるのか?」この疑問を解決するために、頭部外傷モデルマウスや細胞を用いて研究を行います。
炎症性腸疾患がパーキンソン病発症リスクを高めるメカニズムの解明
疫学調査により、炎症性腸疾患患者はパーキンソン病発症のリスクが1.4倍に増加することが報告されました。しかしそのメカニズムは明らかではありません。「なぜ炎症性腸疾患になるとパーキンソン病を発症しやすくなるのか?」この疑問を解決するために、炎症性腸疾患モデルマウスを用いて研究を行います。
薬物動態研究
病気になると、薬物動態が変化することがあります。この病態に依存した薬物動態の変化が、医薬品による治療抵抗性(治療効果の減弱)や副作用発現の原因となっている可能性があります。医薬品や栄養素の脳移行が病気や性ホルモンの変動により変化し、今まで飲んでいた薬が効かなくなったり、副作用が現れたりする可能性も?
病気や性ホルモンの変動に依存した血液脳関門機能変化に着目し、より効果的にそして安全に、医薬品や栄養素を脳に送り届けるための方法を考えます。
潰瘍性大腸炎病態下における、医薬品や栄養素の脳移行性変化を解明
潰瘍性大腸炎では、血液脳関門(BBB)における薬物排出トランスポーターの機能が亢進し、脳に医薬品が行きにくくなります。腸炎症モデルマウスや細胞を用いて、医薬品の脳移行性を評価します。
女性ホルモンの変動に伴う、医薬品や栄養素の脳移行性変化を解明
女性ホルモンは、月経周期に伴い変動するとともに、加齢に伴い徐々に減少します。「女性ホルモンの変動が、医薬品や栄養素の脳移行性を変化させるか?」この疑問を解決するために、血液脳関門機能変化に着目し、女性ホルモンを減少させたマウスや細胞を用いて研究を行います。
加齢により低下する医薬品や栄養素の脳移行性をどのように改善する?
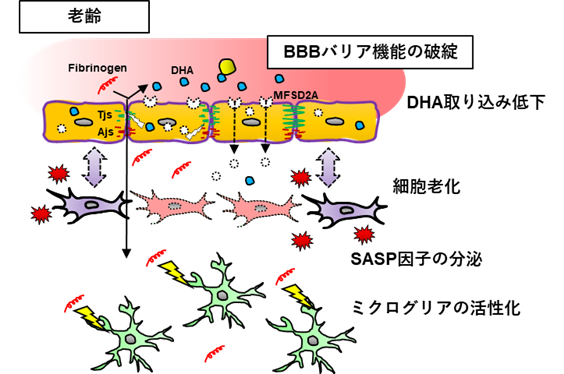
加齢により、機能性食品(DHA)や脳治療薬(抗てんかん薬)は血液脳関門(BBB)を透過しにくくなるため、脳に行きにくくなります。加齢により低下したDHAの脳移行が、機能性食品の摂取により改善するかを解明するために、老齢マウスや細胞を用いて研究を行います。
加齢に伴い血液脳関門 (Blood-Brain Barrier; BBB)のバリア機能が脆弱化することが知られています。バリア機能のみならず、脳にとって重要な栄養素であるDHAの脳移行性が低下することを我々は明らかにしました。しかし、“なぜ加齢に伴いBBB機能が変化するのか”については未だに不明な点が多いです。我々は、BBBを構成する細胞の中でも特にペリサイトの変化に着目し、加齢に伴うBBB機能変動機構の解明を目指しています。
加齢性BBB機能障害が神経変性疾患の病態形成に及ぼす影響の解明
多くの加齢性神経変性疾患(アルツハイマー病、パーキンソン病、高齢発症てんかん、大脳白質病変)の病態形成において、BBBバリア機能の破綻が関連しています。“若い人では発症しないのに、なぜ高齢者で発症するのか?”この点において、我々は「加齢に伴い脆弱化するBBBが神経変性疾患の病態形成に寄与しているのでは」と考えており、研究を進めています。現在ターゲットにしている疾患は、大脳白質病変、高齢発症てんかん、パーキンソン病で、これらの動物モデルを使用し研究を行います。
BBBをターゲットにした新たな予防・治療戦略の構築
これまでに加齢性神経変性疾患に対する様々な治療薬が開発されていますが、現在も“疾患を克服する”治療薬は存在しません。加齢性神経変性疾患の治療が困難な要因として、脳神経への異常タンパク質(アミロイドβ、αシヌクレイン)の蓄積のみが病態形成に寄与しているのではなく、加齢による様々な生理機能の変化が寄与していることが考えられます。BBBバリア機能の破綻は血中から脳内への血中タンパク質の流入を招き、神経機能障害や脳内炎症を惹き起こすことが知られています。そのため、加齢に伴うBBB機能の破綻は多くの神経変性疾患の病態形成に寄与していると考えられます。そこで、神経変性疾患の予防・治療において、加齢に伴うBBB機能の正常化(若返り?)は新たな治療戦略になるのではと考えています。現在は特に、DHAのBBBに対する効果を検証しています。
多発性硬化症の新規治療法の開発
多発性硬化症は自己免疫によって神経軸索の髄鞘が障害される自己免疫疾患と考えられています。現在の治療薬は、過剰な自己免疫を抑制する治療薬が使用されていますが、破壊された髄鞘を回復させる治療薬は存在しません。そのため、我々は髄鞘を再生させる治療法を開発することを目的に研究を進めいてます。
ヒトiPS細胞を活用した研究(発達性てんかん性脳症の病態解明および創薬基盤研究)
【背景】
発達性てんかん性脳症(DEE)は、主に乳幼児に発症し、難治性のてんかん発作に加え精神運動発達の遅滞・退行を伴う疾患群です。患者や家族の生活に大きな影響を及ぼす重篤な疾患ですが、その分子病態については不明な点が多いため、治療は効果の乏しい対症療法に限られています。本研究の対象疾患であるDravet症候群もDEEを発症する代表的な難治性疾患(指定難病140)であり、発作重積等により約3割の患者が若年死亡することが知られています。Dravet症候群は、原因となる遺伝子異常が明確となった数少ない乳児期発症難治性てんかんの一つであり、主に電位依存性Na+チャネル(Nav1.1)のαサブユニットをコードするSCN1A 遺伝子の異常が同定されます。この遺伝子変異により、発達期の前脳における抑制性GABA作動性神経細胞の機能不全により脳神経ネットワークの過剰興奮が誘起され、重篤なてんかん発作を発症すると考えられています。
【目的】
本研究は未だ不明であるDEEの発症機序の解明を目的としています。①:どのようにDEEの発症が発症し、突然死に至るのか? ②:どのように精神運動発達の遅滞・退行が引き起こされるのか? それらの原因を明確にすることで、革新的な治療法や創薬研究の発展に寄与し、患者を治療することが最終目標です。
【研究内容】
本研究室では、疾患特異的iPS細胞を用いて、DEEの病態解明と創薬研究に取り組んでいます。患者のiPS細胞から分化誘導した神経細胞(グルタミン酸作動性やGABA作動性ニューロンなど)やグリア細胞(アストロサイトなど)を用いて、分子レベルでの病態解明に取り組んでいます。また、ヒトの脳組織の一部分を模倣した脳オルガノイド(ex vivoモデル)を用いた病態解析も行っています。ヒトiPS細胞から細胞培養ディッシュ中で三次元の組織を作製することにより、脳が発達する過程をin vitroで観察できるため、発生過程を経時的に再現しながら細胞内の因子を直接解析することが可能です。
創薬シーズの社会実装に向けた取り組み
本学医学部・廣瀨教授との共同研究成果として、Dravet症候群の治療薬となりうる化合物の同定にも成功しています(特許取得)。現在は、Dravet症候群の根治を目指し、同疾患のモデルマウスを用いて、これら化合物の有効性を検証中です。加えて、創薬シーズの社会実装を実現するために株式会社iONtarget(創薬ベンチャー)も設立し、創薬研究を加速させるための事業展開も行っています。